Nat. Commun.|国科大杭高院蓝乐夫课题组合作揭示MRSA毒力基因表达调控的新机制
近日,威斯尼斯人wns888入口中国(国科大杭高院)药物科学与技术学院蓝乐夫课题组及其合作者发现甲氧西林耐药金黄色葡萄球菌(MRSA)毒力基因表达调控的新机制,相关研究成果以“Modulation of MRSA virulence gene expression by the wall teichoic acid enzyme TarO”为题, 于2023年3月22日在线发表于Nature Communications杂志(国科大杭高院为第一署名单位)。

MRSA是一种“超级细菌”,对许多传统抗生素均具有耐药性, 临床治疗非常棘手,被世界卫生组织列为“对人类健康构成最大威胁的12种重点病原体之一”。酚可溶性调控蛋白(PSM)和葡萄球菌A蛋白(SpA)是社区型MRSA(CA-MRSA)的重要毒力因子。目前,通过抑制毒力因子的毒性作用或其表达的抗毒力疗法(Anti-virulence therapies)是一种潜在的抗细菌感染新策略。
在这项研究中,研究人员通过对3,987个化合物进行活性筛选,发现衣霉素在纳摩尔的浓度下可明显降低CA-MRSA中PSM基因的表达;在纳摩尔的浓度下,衣霉素也可抑制CA-MRSA中SpA的表达。进一步研究发现,衣霉素通过抑制壁磷壁酸(Wall teichoic acid, WTA)合成酶TarO的功能,引起青霉素结合蛋白PBP2功能受损、双组分信号转导系统VraRS的高度激活,从而导致PSM基因和SpA基因的表达水平急剧下调。通过利用动物感染模型,研究人员发现TarO基因的缺失突变导致金黄色葡萄球菌CA-MRSA菌株USA300 LAC基本上丧失了对大蜡螟幼虫和小鼠的致病能力。
抑制TarO如何引起VraRS的激活?研究人员进一步利用遗传学和细菌显微成像等研究方法,发现抑制TarO可通过依赖于mecA的途径和不依赖于mecA的途径来激活VraRS。化学遗传学的研究结果表明,PBP2前体分子lipid II的累积可能是VraRS激活的一个重要原因。
综上所述,这项研究揭示了WTA/PBP2a-PBP2/VraRS是一个对CA-MRSA毒力基因的表达具有重要调控作用的调节轴,为开发靶向TarO的抗CA-MRSA感染药物特别是抗细菌毒力药物(anti-virulence drugs)提供了新的理论依据。这项研究也揭示了外源性mecA基因的获得不仅可介导细菌对β-内酰胺类抗生素的耐药,而且对细菌的细胞信号转导、毒力基因的表达调控等产生了深远的影响,拓展了当前对mecA生物学功能的传统认知。
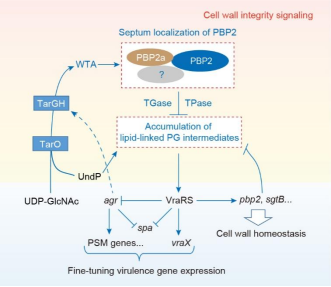
图1. TarO对CA-MRSA毒力基因表达的调控机理
论文的共同第一作者为国科大杭高院/中科院上海药物所联合培养博士生鲁云福、国科大杭高院/西北大学联合培养在职博士生(中科院上海药物所副研究员)陈菲菲;通讯作者为国科大杭高院蓝乐夫研究员、西北大学梁海华教授(现任职于南方科技大学)。该研究工作得到中科院上海药物所黄锐敏课题组、上海交通大学医学院附属仁济医院李敏课题组、美国印第安纳大学西北医学院Taeok Bae课题组的支持,并获得国家自然科学基金委、上海市科委、新药研究国家重点实验室等的资助。
蓝乐夫课题组主要从事细菌致病性的形成机制与药物靶点研究,这项研究也是今年继该研究团队及其合作者在PLOS Pathogens(2023, 19:e1011110)和Virulence(2023, 14:2171641)等杂志发表研究论文后,取得的一项新的研究进展。因工作需要,该课题组正在招聘科研人员,欢迎有意者应聘。详情请见:https://mp.weixin.qq.com/s/b7JNxnR_G5C6LIQqEZDAnQ
原文链接:https://www.nature.com/articles/s41467-023-37310-5
 国科大杭高院药学院
国科大杭高院药学院