抗体药物偶联物(ADC)通过抗体实现细胞毒药物的靶向递送,具有更好的治疗效果及安全性。传统ADC化合物往往将小分子细胞毒药物随机偶联到抗体的赖氨酸或半胱氨酸,连接数量随机,在2-6之间。相较于传统ADC化合物,定点ADC则将细胞毒药物选择性地偶联到抗体的特定位点上,具有均一性好、质控稳定、治疗窗较宽等显著优势,现已成为ADC的研究热点。目前主流的抗体定点修饰技术通常涉及非天然氨基酸的插入或酶催化反应,技术瓶颈高,过程复杂;而利用化学手段实现定点ADC的制备一般需要多步反应,工艺复杂,且多局限于生物正交反应引入药物连接子,不利于定点 ADC药物的多样性开发。
近日,国科大杭高院药物科学与技术学院黄蔚工作室(国科大杭高院为第一署名单位)在《Angewandte Chemie International Edition》发表了题为A Traceless Site-Specific Conjugation on Native Antibodies Enables Efficient One-Step Payload Assembly的文章。

该工作发展了一种新型配体导向的化学修饰手段,无需对抗体进行工程化改造,可以直接实现天然抗体位点选择性的、“纯化学”的、高效的小分子药物“一步”定点偶联,为定点ADC药物研发提供重要的合成技术。研究团队设计了结构为“Fc配体-酰化试剂-装载分子”的复合物,其中Fc配体为与抗体Fc段具有高亲和力的环肽,作为导向基团;酰化试剂在一般条件下稳定,在抗体特定位点附近发生断裂并使配体分子自行离去,“无痕”实现了叠氮基团、生物素以及细胞毒素等在抗体特定位点的一步快速偶联(图1)。
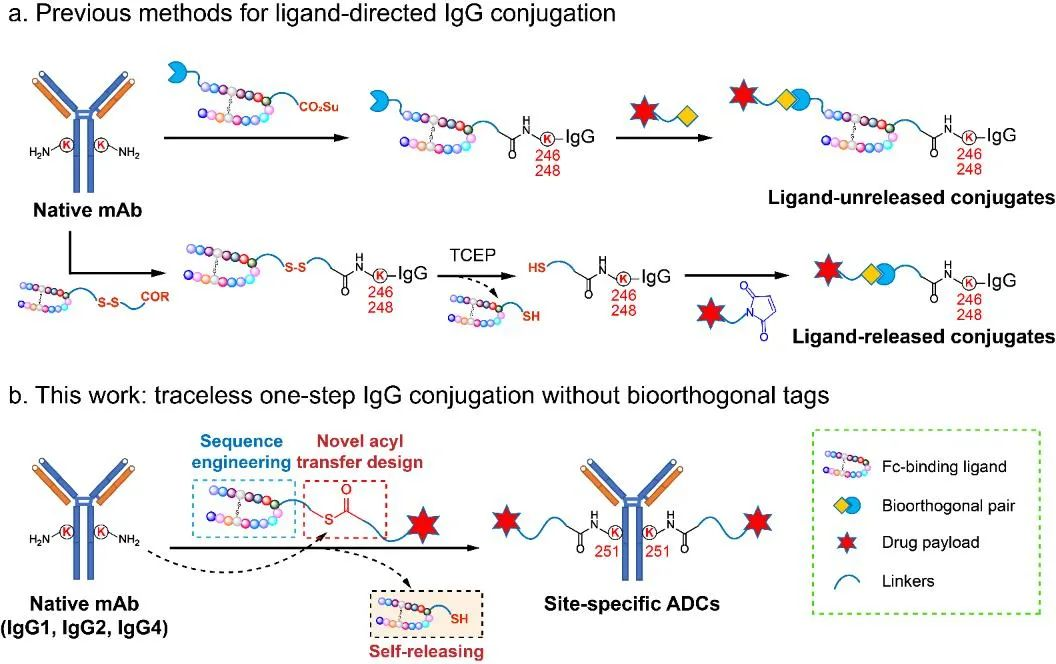
图1 (a)多步反应实现配体导向的抗体定点修饰技术(已报道工作);(b)Fc配体导向的一步无痕制备定点ADC(本文工作)。
研究团队通过优化酰化试剂结构(图2)、配体结构、连接片段长度(图3),最终确立了硫酯结构作为酰基转移试剂,在特定配体的作用下,成功实现了天然抗体的一步无痕定点修饰,并对修饰位点进行了确证(图4)。随后,研究团队利用该技术实现了结构多样的K251位定点ADC的“一步”制备;同时该技术可以应用于其它不同亚型的抗体,验证了该方法的普适性(图5)。后续的结构表征显示所制备的定点ADC具有良好的均一性、稳定性(图6)以及体内外活性(图7)。
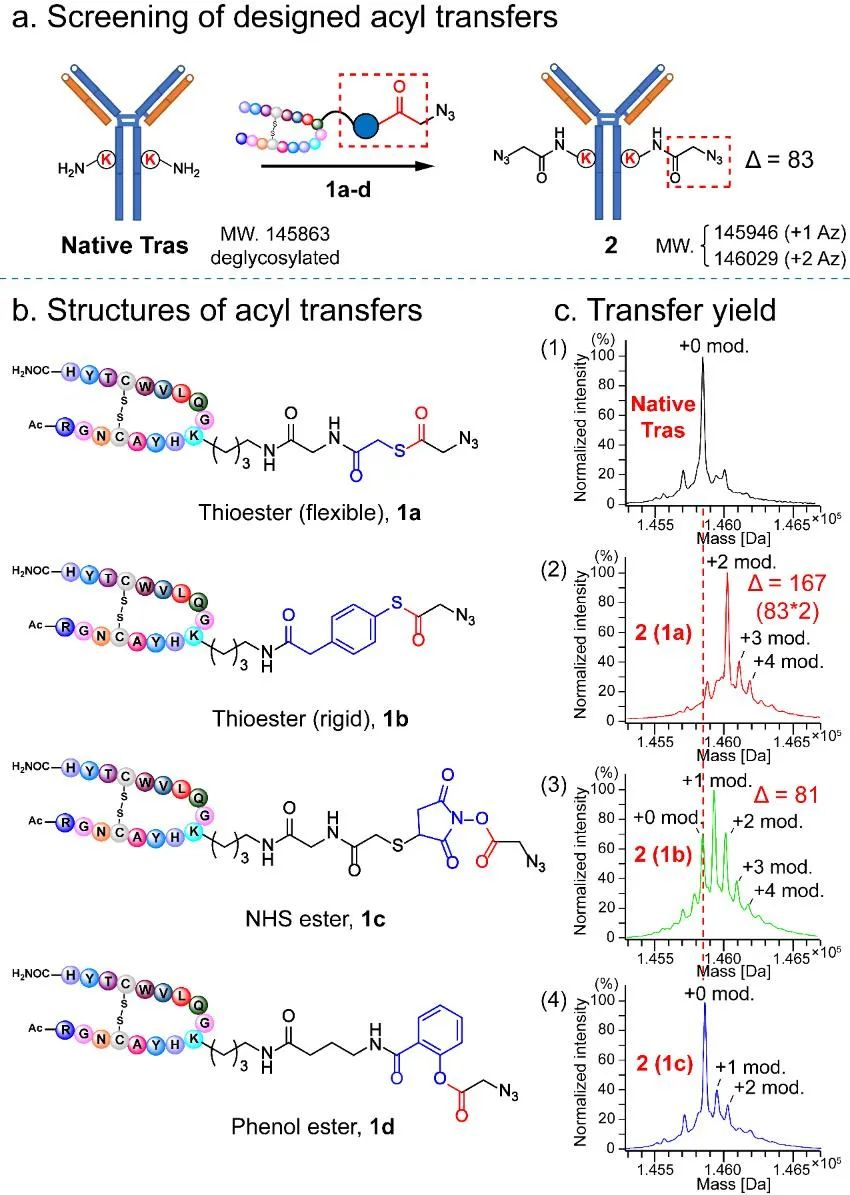
图 2 酰基转移试剂的设计及筛选。(a)一步定点叠氮化曲妥珠单抗示意图;(b)候选酰基转移试剂结构;(c)曲妥珠单抗与酰基转移试剂1a,1b,1c,1d共孵育后的叠氮化效率(所有单抗在Ms分析前均已用EndoS酶除去不均一糖链)。
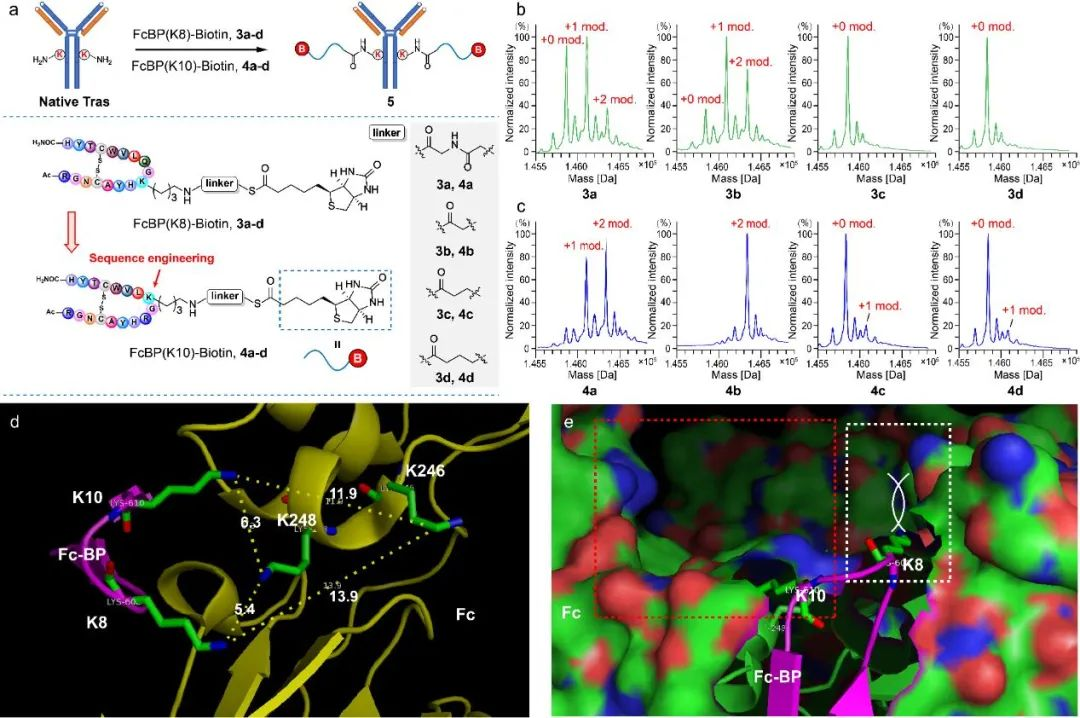
图3 Fc配体及连接子结构优化。(a)Fc配体-硫酯-生物素复合物的结构设计;(b)3a-d生物素化曲妥珠单抗效率图;(c)4a-d生物素化曲妥珠单抗效率图;(d)Fc配体(紫色)K8与K10距离抗体Fc(黄色)K246及K248(EU编号)位置相当;(e)Fc配体与Fc共晶模型显示K8处较为拥挤,而K10处具有较大空腔。
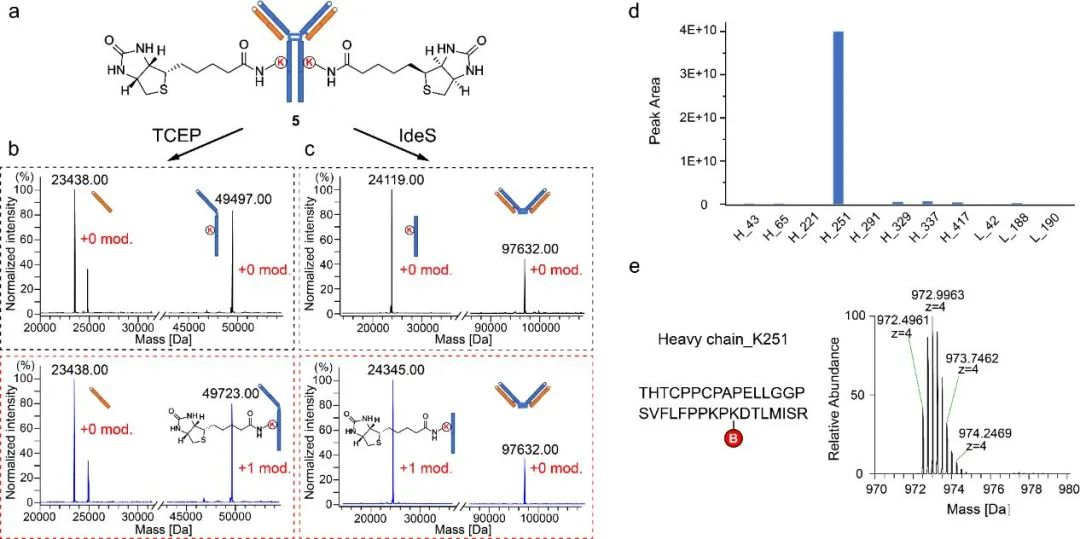
图4 生物素化曲妥珠单抗5修饰位点分析。(a)生物素化曲妥珠单抗5结构;(b)生物素化曲妥珠单抗5(红框)及野生型曲妥珠单抗(黑框)轻重链修饰分析;(c)生物素化曲妥珠单抗5(红框)及野生型曲妥珠单抗(黑框)Fab及Fc片段修饰分析;(d-e)生物素化曲妥珠单抗5肽图分析结果。(所有单抗在Ms分析前均已用EndoS酶除去不均一糖链)。
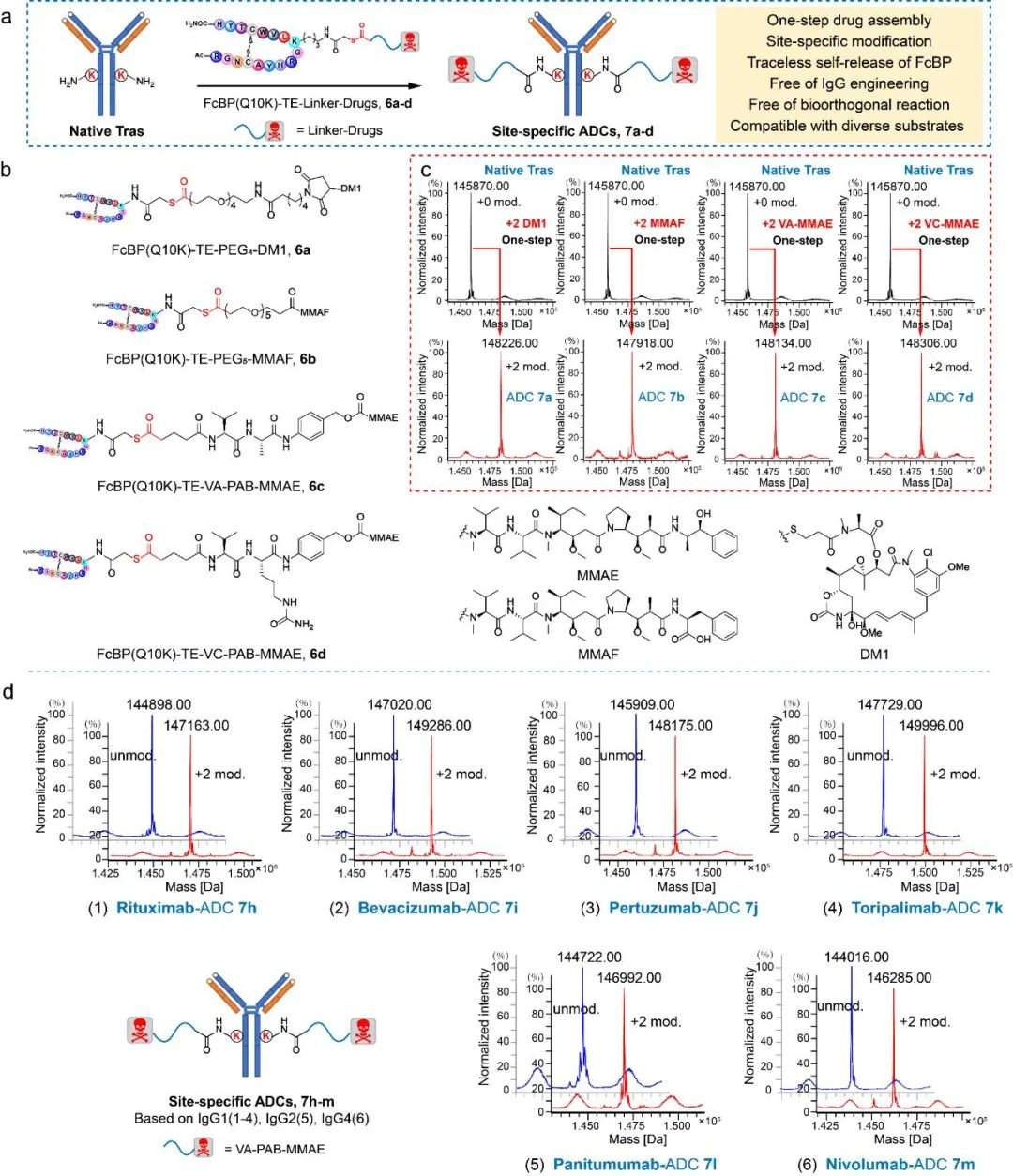
图5 天然抗体一步无痕制备定点ADC。(a)一步制备定点ADC示意图;(b)Fc(K10)-硫酯-药物连接子结构;(c)天然抗体一步无痕制备定点ADC Ms表征图;(d)天然IgG1, IgG2, 及IgG4一步无痕制备定点ADC Ms表征图。(所有单抗在Ms分析前均已用EndoS酶除去不均一糖链)。
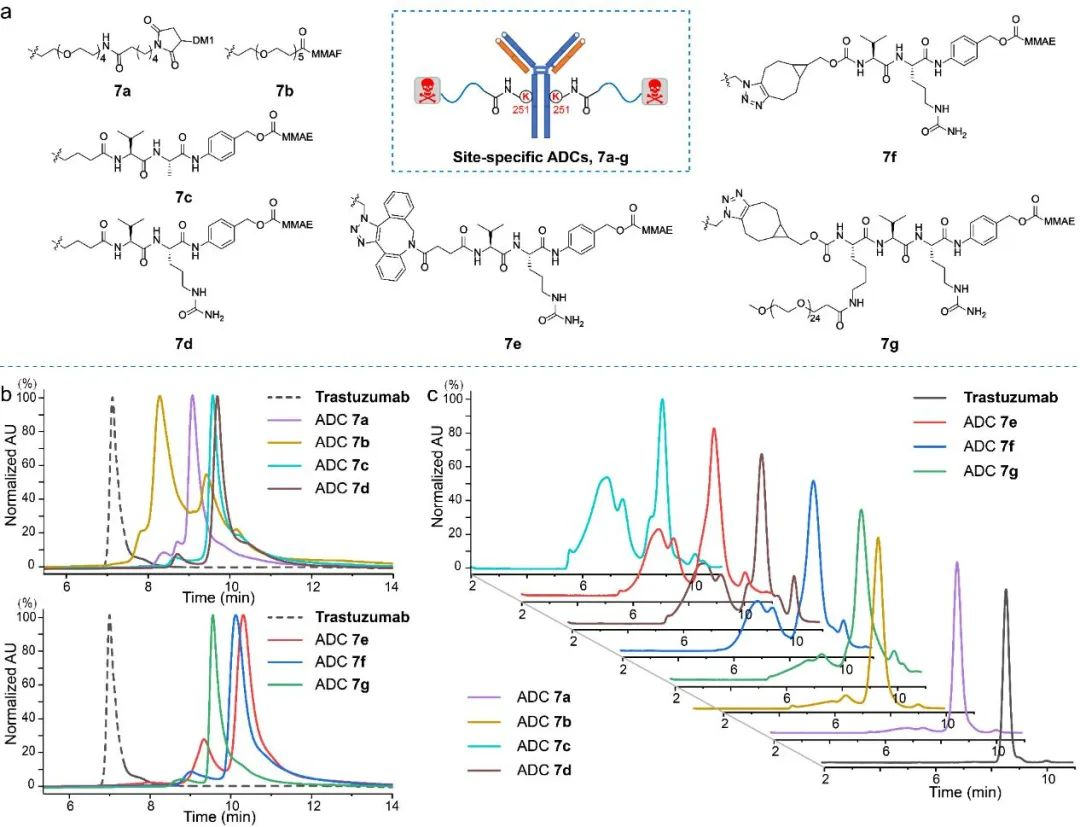
图6 定点ADC 7a-g HIC及SEC分析图。(a)定点ADC 7a-g结构;(b)定点ADC 7a-g HIC图;(c)定点ADC 7a-g 60°C处理48小时 SEC图。
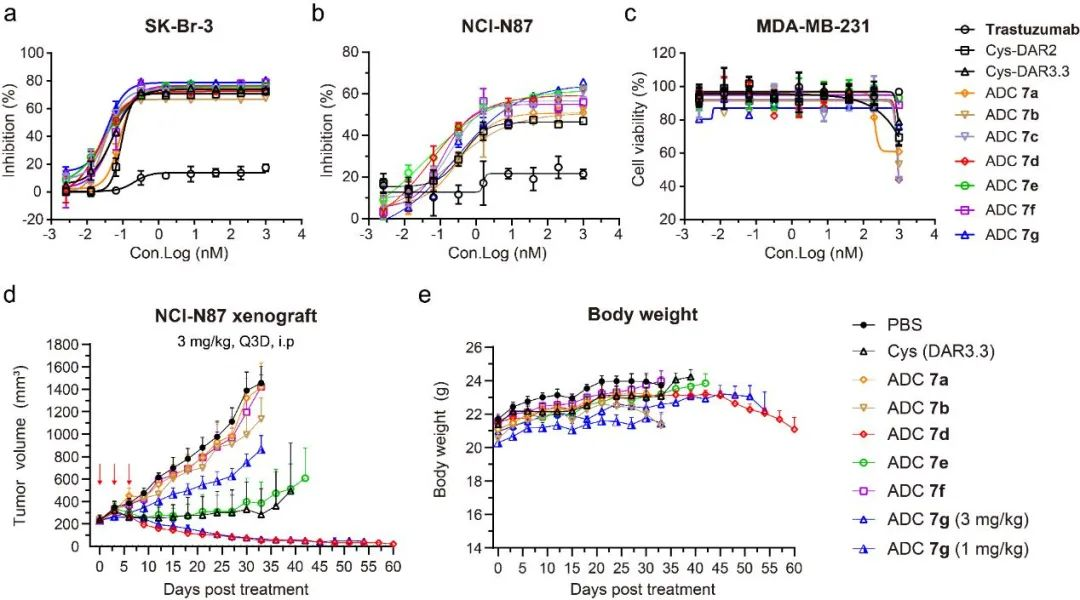
图7 定点ADC 7a-g体内体外抗肿瘤活性。(a)定点ADC 7a-g体外抗肿瘤活性(SK-Br-3);(b)定点ADC 7a-g体外抗肿瘤活性(NCI-N87);(C)定点ADC 7a-g体外抗肿瘤活性(MDA-MB-231);(d-e)定点ADC 7a-g 体内抗肿瘤活性及毒性(NCI-N87移植瘤模型)。
该论文还得到了来自上海药物所周虎研究员、黄河研究员、刁星星研究员在小分子修饰位点鉴定方面的大力支持和帮助。该工作得到国家自然科学基金、中科院特别研究助理项目、上海市扬帆计划、上海市科技重大项目、杭州创新创业领导团队项目及临港实验室的基金支持。
原文链接
https://onlinelibrary.wiley.com/doi/10.1002/anie.202204132
 国科大杭高院药学院
国科大杭高院药学院