a)具有除氧能力的自激活纳米囊泡用于乏氧响应的化疗/光热联合癌症治疗
乏氧激活前药(HAPs)是一类响应低氧环境激活药效的化合物,可有效避免传统化疗副作用并有望实现精准治疗。不过现有的肿瘤乏氧化疗策略需要进行耗氧剂的靶向递送或者外源刺激,限制了HAPs的临床应用。
陈航榕教授团队基于壳聚糖(Chitosan)和胆红素(BR)的共轭物,巧妙构建了一种具有肿瘤区域原位自激活功能的新型纳米载药囊泡—TH-302@BR-Chitosan NPs。研究发现,胆红素-壳聚糖纳米囊泡可与氧气反应,特别是在过氧化氢高表达的肿瘤区域,胆红素-壳聚糖表现出了高效耗氧性能,可原位转变为具有良好光热转化效应的胆绿素-壳聚糖共轭物。同时由于肿瘤组织/细胞内低pH值促使壳聚糖质子化,导致纳米囊泡解离释放乏氧前药,进一步增强肿瘤乏氧程度。增强的肿瘤乏氧水平有利于激活乏氧前药实施化疗抗癌作用;同时原位激活形成的胆绿素-壳聚糖可与乏氧前药一起实施化疗-热疗的联合疗法。活体实验证实,该胆红素-壳聚糖基纳米载药囊泡对Hela肿瘤模型具有优异的联合抑制作用。简言之,该研究构建了一类组成简单、生物降解性良好的智能响应型纳米载药体系,揭示了其高效的肿瘤乏氧构建和原位激活光热试剂的能力,可用于实施乏氧响应的化疗-热疗联合癌症治疗,为基于乏氧的肿瘤治疗提供了新的策略。(Biomaterials,2020, https://doi.org/10.1016/j.biomaterials.2020.120533)
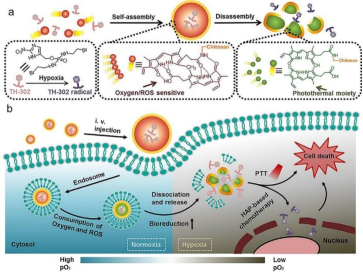
纳米载药体系的光热-乏氧化疗联合治疗示意图
b)光热促进纳米催化并联合H2S介导呼吸抑制用于高效肿瘤治疗
化学动力学治疗(Chemodynamic Therapy, CDT)是利用Fe基等功能纳米粒子在肿瘤微环境(TME)酸性和过氧化氢等条件下,原位引发肿瘤组织或肿瘤细胞内芬顿或类芬顿反应产生强氧化性的羟基自由基(·OH),从而诱导癌细胞死亡的一种治疗方式。不过依赖单一铁基材料的CDT往往受限于TME的弱酸性和低含量的H2O2,其治疗效果并不理想。气体治疗(Gas Therapy, GT)是近年来兴起的基于H2S、NO、CO等特异性气体信号分子来实施对肿瘤细胞高效抑制的一种治疗模式,受到了研究者极大关注。
陈航榕教授团队提出采用简单一步水热法成功合成了聚合物修饰的具有高分散和稳定性的Fe1-xS-PVP纳米颗粒,其在808nm激光照射下呈现优良的光热转化效率(24%),能有效促进芬顿反应产生更多·OH。更重要的是在肿瘤弱酸性环境中(pH6.5),Fe1-xS-PVP纳米颗粒通过解离S2-并结合H+,能原位生成H2S气体。进一步研究发现产生的H2S能有效抑制细胞线粒体中细胞色素C氧化酶(COX IV)的表达。COX IV是线粒体内膜上电子转运链末端金属膜酶,是细胞有氧呼吸和ATP产生的重要组成部分。体内/外实验结果证实了这种利用光热促进芬顿过程并联合H2S介导的气体治疗具有良好的抗肿瘤效果(图2示意)。(Advanced Functional Materials, 2020, 2007991)。
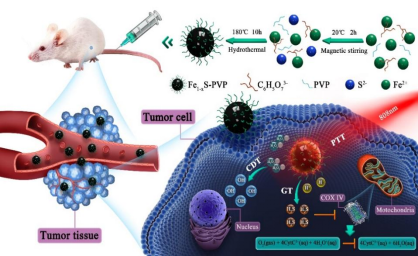
Fe1-xS-PVP介导的GT/PTT/CDT协同治疗示意图