9月13日,国际学术期刊Cell Research在线发表了威斯尼斯人wns888入口中国/中科院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈剑峰课题组和曾艺课题组与中科院分子细胞科学卓越创新中心曾安课题组合作完成的最新研究成果“ Integrin αEβ7+ T cells direct intestinal stem cell fate decisions via adhesion signaling”。该工作发现肠道T细胞表面的整合素αEβ7,通过与肠道干细胞表面的E-cadherin形成粘附,进而通过改变E-cadherin下游粘附信号来调控肠道上皮细胞的增殖与分化命运从而维持肠道稳态的新机制。
肠道上皮的快速更新是维持肠道稳态的重要生命活动。肠道上皮更新起始于位于肠道干细胞表面受体对其周边微环境信号的感应,进而通过调控肠道干细胞内不同分化信号决定其分化方向,最终分化为不同功能的终端细胞。免疫细胞作为肠道干细胞微环境中新的一员受到广泛关注,但是T在正常生理状态,免疫细胞是否以及如何参与对肠道上皮细胞可塑性的调控仍然知之甚少。
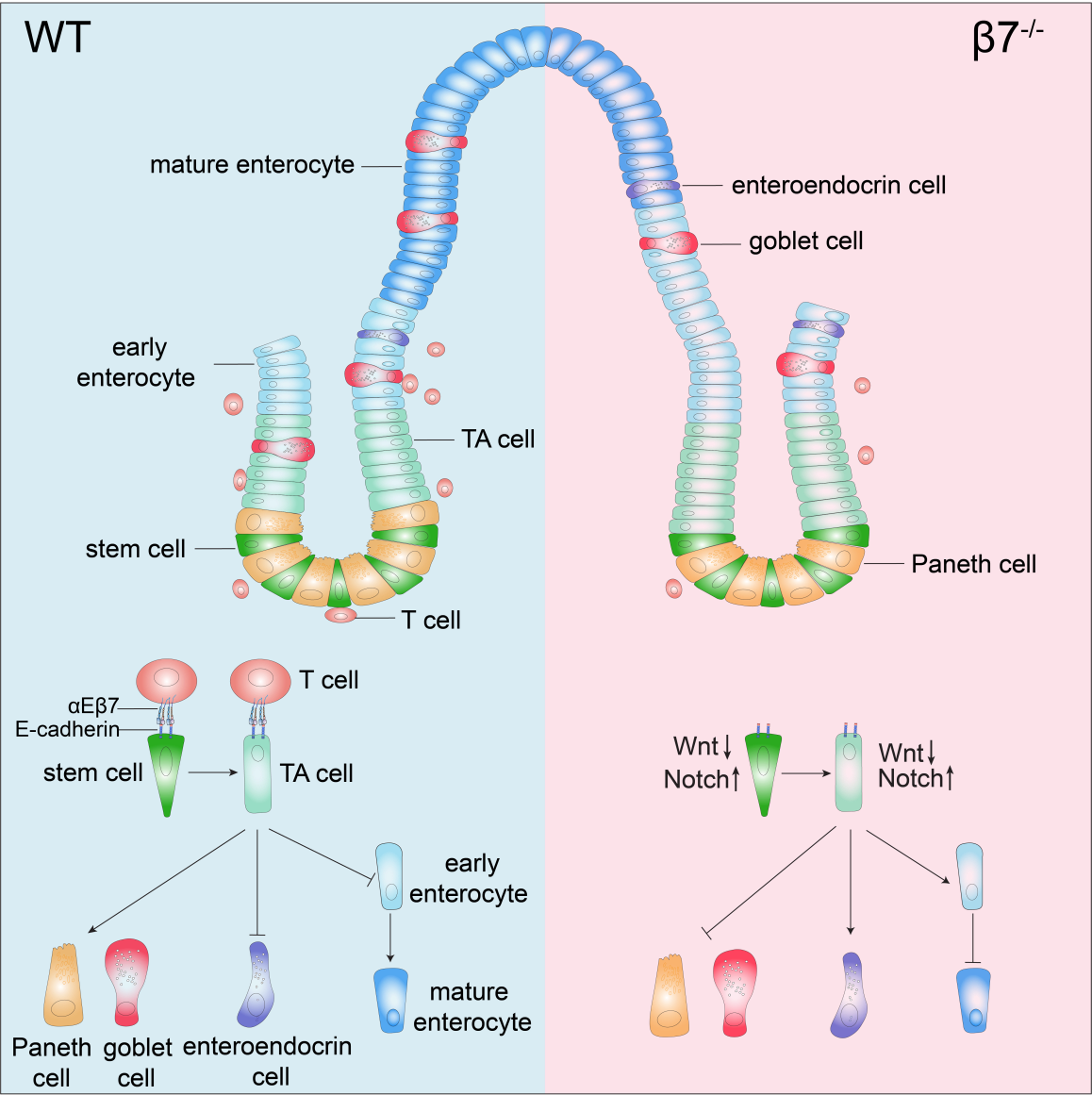
本研究工作发现,肠道隐窝部位T细胞与肠道干细胞会发生粘附作用,该粘附由T细胞表面整合素αEβ7与肠道干细胞表面的粘附分子E-cadherin介导。肠道T淋巴细胞的缺失会导致肠道上皮细胞增殖和分化的异常。正常T细胞的过继移植能够恢复整合素β7敲除小鼠上皮细胞的分化异常。单细胞转录组测序等实验结果表明,整合素β7敲除小鼠的肠道干细胞和TA细胞中Wnt信号通路受到抑制,而Notch信号通路以及细胞周期相关的基因表达上调。进一步的分子机制研究发现,肠道T细胞通过其表面表达的整合素αEβ7与上皮细胞上的E-cadherin结合,并通过E-cadherin内化调控Wnt和Notch信号通路,进而调控肠道上皮细胞的分化。综上所述,该研究工作发现了肠道淋巴细胞可以通过与肠道上皮细胞接触方式在单细胞水平调控肠道上皮细胞可塑性;并提出了αEβ7—E-cadherin介导的细胞间粘附信号调控肠道干细胞命运决定的概念。这些发现将拓宽人们对细胞可塑性调控的理解,强调了淋巴细胞所提供的粘附信号对于肠道干细胞命运决定的重要性。
威斯尼斯人wns888入口中国博士后陈世阳,分子细胞科学卓越创新中心郑雅娟和冉晓娟博士为共同第一作者。威斯尼斯人wns888入口中国/分子细胞科学卓越创新中心陈剑峰研究员、曾艺研究员以及分子细胞科学卓越创新中心曾安研究员为共同通讯作者。该项研究获得国家自然科学基金委、科技部、中科院先导等项目经费的资助。该工作得到中科院分子细胞卓越中心的分子生物学技术平台、细胞分析技术平台、实验动物平台的大力支持。特别感谢中科院分子细胞科学卓越创新中心李林研究员、葛高翔研究员、王红艳研究员以及耶鲁大学医学院吴殿卿教授等提供的帮助。
文章链接:https://www.nature.com/articles/s41422-021-00561-2

