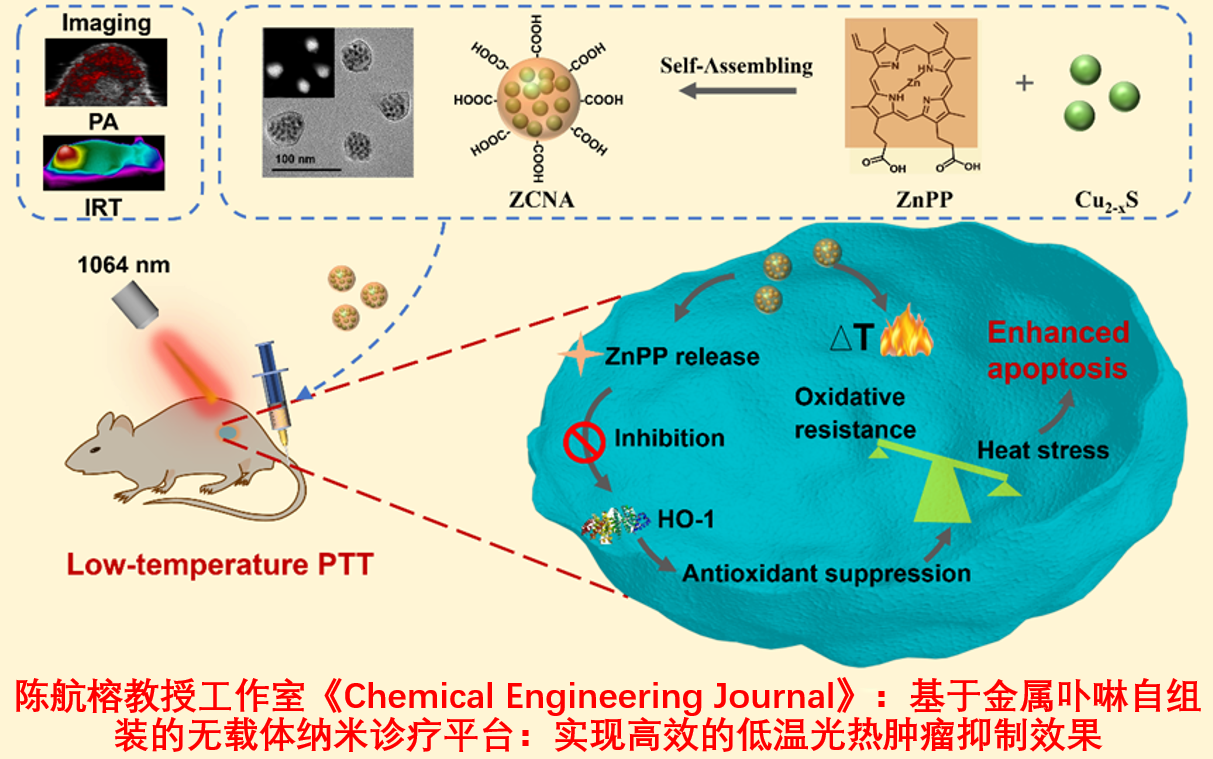
光热疗法(PTT)作为一种新兴的肿瘤治疗模式,通过光热试剂将光能转换为热能而实现肿瘤的热消融。在PTT中,病灶区的温度通常高于50℃,如此高的温度在杀伤肿瘤细胞的同时不可避免的会对周围正常组织造成热损伤,而且肿瘤细胞破裂释放的细胞因子也会促进肿瘤转移,为了降低高温PTT的副作用,研究人员提出了低温(≤45℃)PTT,但是肿瘤细胞中热休克蛋白(HSP)的过表达会修复细胞热损伤,降低了低温PTT的疗效。此外在纳米诊疗平台构建方面,纳米材料的制备仍然面临着制备载药率低、过程复杂、重复性差以及成本高等问题,因此多功能纳米材料制备技术的开发具有重大的临床应用意义。
基于以上问题,本工作设计了一种基于金属卟啉自组装的无载体纳米诊疗平台,该平台通过弱化细胞的抗氧化防御系统,进而实现高效的低温光热肿瘤抑制效果。首先我们提出了一种新的材料制备方法-溶剂挥发驱动的纳米自组装,在无需表面活性剂的情况下,将疏水的原卟啉锌(ZnPP)和油酸修饰的超小硫化铜(Cu2-xS)一步自组装为粒径均一、水溶性及生物相容性良好的纳米药剂(ZnPP/Cu2-xS nanoagent-ZCNA)。由于ZCNA 的构建不需要额外载体,Cu2-xS和ZnPP的负载效率及负载量分别高达90.1%和41.2wt%, 94.6%和58.8。Cu2-xS作为一种优良的近红外二区光热试剂及光声造影剂,具有超高的光热转换效率(37.6%),可有效的将光能转换为热能,实现光声成像介导的肿瘤热消融。ZnPP作为血红素加氧酶-1(HO-1,一种抗氧化应激酶,属于HSP)的抑制剂,在ZCNA进入肿瘤细胞后,释放的ZnPP可以有效地下调肿瘤细胞中HO-1的表达,降低肿瘤细胞热阻。当ZCNA吸收近红外二区激光(1064 nm)并转化为热的同时,由于细胞的抗氧化防御系统被破坏,细胞的耐热能力降低,因此可以实现较低温度(≤45℃)下肿瘤的高效杀伤效果,从而避免了高温(>50℃)PTT引起的副作用。体外研究实验表明,ZCNA具有良好的生物相容性和生物安全性,基于ZCNA的低温光热肿瘤抑制效率可高达93.5%。该研究不仅开发了用于多功能纳米材料制备的新方法,拓宽了功能型金属卟啉小分子应用,而且提出了用于低温光热抗肿瘤研究的新策略,为实现精准高效的肿瘤治疗提供了有益的参考。相关研究以“A metal protoporphyrin-induced nano-self-assembly for potentiating photothermal therapy by depleting antioxidant defense systems”为题发表在Chemical Engineering Journal上(DOI:10.1016/j.cej.2021.129769)。该工作得到了国家自然科学基金(No.32030061、No.51772316、No.52072392)、上海市启明星计划(No. 19QA1410300)等项目的支持。