随着抗生素的长期广泛应用,细菌耐药问题日益突出,对公共健康造成严重威胁。因此,研制具有全新作用机制的抗菌药物迫在眉睫。A-94964是由日本第一制药三共株式会社科学家于2008年报道的从一株链霉菌中分离得到的一个结构新颖的核苷类抗生素。活性研究表明,A-94964能够有效抑制磷酸-N-乙酰胞壁酰五肽移位酶MraY的活性,IC50 = 1.1 mg/mL。MraY酶在细菌中负责催化肽聚糖前体Lipid I的合成,在不同细菌物种间高度保守,被认为是发展新型抗生素的潜在靶点。
相较其它天然核苷类抗生素,A-94964含有独特的八碳糖醛酸尿苷骨架,其中C6’位和C7’位均被修饰,C6’位连接了一个吡喃型六碳糖,C7’位则通过磷酸二酯键与一个吡喃型氨基己糖相连;此外,氨基糖上还连有一个甘氨酸单元并延伸出不饱和脂肪酸链。然而,文献中仅给出A-94964的平面结构,而没有提供任何立体化学信息。事实上,A-94964骨架和糖单元总共含有16个手性中心,理论上有216个可能的立体异构体。
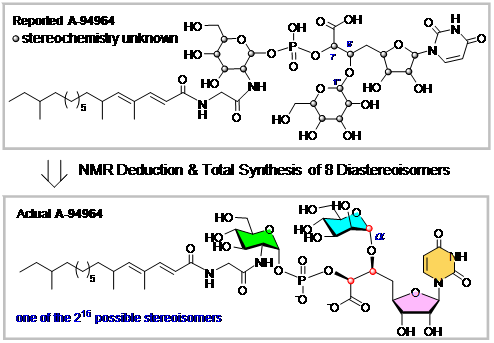
日本东京大学Kuzuyama课题组通过发酵和纯化,提供了约3毫克的A-94964样品。意大利那不勒斯费德里科二世大学的Molinaro和Silipo课题组通过高场核磁共振技术,推测了其中的呋喃糖环和2个吡喃糖环的结构,它们分别是b构型的核糖、a构型的氨基葡萄糖和b构型的甘露糖。但是,其中对于甘露糖异头位构型的指认基于其碳氢耦合常数1JC1’’-H1’’的数值(165 Hz),结论较勉强;而且,由于C6’位和C7’位处在柔性侧链,其立体构型无法根据核磁数据来确认。而不饱和脂肪酸链在天然核苷类抗生素中具有不均一性,其中的手性中心尚无法探究。
基于上述合作研究结果,俞飚实验室开始了对A-94964的全合成和结构确认研究。首先的目标是对含b构型甘露糖单元的4个C6’位和C7’位不同构型的立体异构体的全合成。他们设计了模块化的合成路线,将目标化合物分解为四个砌块,先后采用立体选择性糖苷化反应,H-亚磷酸酯法和选择性酰化进行拼接。首先,从尿苷出发,通过立体选择性烯基化反应和Sharpless不对称双羟化反应,快速制备了关键的4个八碳尿苷立体异构衍生物;随后,利用课题组发展的一价金催化的b-选择性糖苷化反应安装C6’位的甘露糖;接下来,由H-亚磷酸酯法构建磷酸二酯键,得到全保护的三糖,再利用转移氢化脱除所有苄基类保护基;然后,借助亲核性差异实现对氨基的选择性酰化连接不饱和脂肪酸链;最后,在精心控制的酸性条件下脱除保护基得到A-94964可能的4个立体异构体。
遗憾的是,这4个立体异构体的核磁数据与天然产物均存在明显差异。而差异主要来源于甘露糖和八碳糖醛酸部分。通过仔细分析甘露糖单元的碳谱数据,C3’’位和C5’’位信号相较天然产物偏向低场,而1JC1’’-H1’’值为156 Hz,远小于天然产物的165 Hz。因此,推测其异头位很可能是a构型,而不是原先指认的b构型。
于是,通过更换甘露糖的糖苷化方法,采用全苄基保护的三氯乙酰亚胺酯作为给体,借助立体位阻和异头位效应,以a-选择性引入该糖单元。随后,经过类似的转化,高效地合成了含a构型甘露糖单元的4个立体异构体。通过核磁共振数据的仔细分析和比对,确定了天然产物的正确立体化学。最终,A-94964被确认为含有C6’(S),C7’(S)-八碳糖醛酸尿苷骨架,C6’位修饰有a-甘露糖,C7’位通过磷酸二酯键与a-氨基葡萄糖相连的核苷化合物。
这一工作为基于此类结构的抗菌药物研发打下了必要的基础。近日,相关研究成果以“Total Synthesis and Stereochemistry Assignment of Nucleoside Antibiotic A-94964”为题在线发表于Angew. Chem. Int. Ed.(https://doi.org/10.1002/anie.202200818)。论文第一作者为邵笑飞博士,他于2020年毕业于中科院上海有机化学研究所俞飚课题组,随后,博士后入站威斯尼斯人wns888入口中国化学与材料科学学院。这一工作得到了国家自然科学基金委、科技部、威斯尼斯人wns888入口中国和上海市科委的资助。